Содержание
Армировка профиля – ЭкспрофСамараСклад
| Ценовая группа/ Номенклатура/ Характеристика номенклатуры | Ед. |
|---|---|
| Армирующие профили | |
| 200 Армирующий профиль 14*32,5*30,5 толщ. 1,4 мм | пог.м |
| 201 Армирующий профиль для створки S-358.26 31*32, 1,4мм. | пог.м |
| 203 Армирующий профиль Exprof (1,0 мм/600) | пог.м |
| 203 Армирующий профиль Exprof (1,2 мм/600) | пог.м |
| 203 Армирующий профиль Exprof (1,35 мм/600) | пог.м |
| 203 Армирующий профиль Exprof (1,4 мм/600) | пог.м |
| 207 (1,2) Армирующий профиль для оконных рам S-358.02, S571.02, (1,2мм/1008) (L=6) | пог.м |
| 207 Армирующий профиль Exprof (1,0 мм/1200) Н | пог.м |
| 207 Армирующий профиль Exprof (1,2 мм/1200) Е | пог.м |
| 207 Армирующий профиль Exprof (1,2 мм/1200) Н | пог. м м |
| 207 Армирующий профиль Exprof (1,35 мм/1200) Н | пог.м |
| 207 Армирующий профиль Exprof (1,4 мм/1200) Е | пог.м |
| 207 Армирующий профиль Exprof (1,4 мм/1200) Н | пог.м |
| 208 Армирующий профиль 80*13*20 1,4 мм | пог.м |
| 28*25 WINTECH Армирующий профиль, (1,2мм/1200) | пог.м |
| 28*25 WINTECH Армирующий профиль, (1,4мм/1200) | пог.м |
| 28*34 WINTECH Армирующий профиль, (1,4мм/1200) | пог.м |
| 337 Армирующий профиль 1,4 мм (600 п.м.) | пог.м |
| 337 Армирующий профиль 32,5*25,5 Exprof (1,2 мм/600) | пог.м |
| 337 Армирующий профиль 32,5*25,5 Exprof (1,4 мм/600) | пог.м |
| 337 Армирующий профиль 32,5*25,5 Exprof (1,5 мм/600) | пог.м |
| 506 Армирующий профиль створки 35*28 Rehau (1,2мм/1008) | пог.м |
| 506 Армирующий профиль створки 35*28 Rehau (1,4мм/1200) | пог. м м |
| 536 Армирующий профиль рамы 35*20 Rehau (1,2мм/1200) | пог.м |
| 536 Армирующий профиль рамы 35*20 Rehau (1,4мм/1008) | пог.м |
| 570 Арм. профиль для S570.19, S358.26, 30*30 толщ. 1,5мм (L=6м) | пог.м |
| 571 Армирующий профиль для рамы 30*20 шв. S-571.01 толщ. 1,2мм | пог.м |
| 571 Армирующий профиль для рамы 30*20 шв. S-571.01 толщ. 1,4мм | пог.м |
| 604 Армирующий профиль для рамы 20*38 S-358.07, толщ. 1,2 мм (L=6) | пог.м |
| 604 Армирующий профиль для рамы 20*38 S-358.07, толщ. 1,4 мм (L=6) | пог.м |
| 604 Армирующий профиль для рамы 20*38 S-358.07, толщ. 2 мм (L=6) | пог.м |
| 606 Армирующий профиль 15*30 Exprof (1,2мм/600) | пог.м |
| 606 Армирующий профиль 15*30 Exprof (1,4мм/600) | пог.м |
| 614 Армирующий профиль 40*50 , толщ. 2мм (П) | пог.м |
| 614 Армирующий профиль 40*50 (1,4мм/240) | пог. м м |
| 614 Армирующий профиль 40*50 (2мм/240) | пог.м |
| 643 Арматура к арт.S-358.12 (1,85м) | пог.м |
| 643 Арматура к арт.S-358.12(труба) (труба ОЦ25ДУ) | пог.м |
| 655 Армирующий профиль Exprof 40*40,толщ (1,4мм/240) | пог.м |
| 655 Армирующий профиль Exprof 40*40,толщ (2мм/240) | пог.м |
| 655 Армирующий профиль фрез. 40*40 (L=2,4L) | шт |
| 655 Армирующий профиль фрез. 40*40 (L=2,4R) | шт |
| 806 Армирующий профиль 28*32 (2мм/600) | пог.м |
| Арматура к арт.S-358.14(T-27т2 мм) | пог.м |
| Б-2015 (1,5) Армирующий профиль для 246.03 | пог.м |
| Б-3223 (1,5) Армирующий профиль для 246.01 и 246.02 | пог.м |
Армирующий профиль арт. 614 |»Алюмтрейд»
- Продукция
- ПВХ профиль
- Funke
- Novotex
- Профили B класса
- Профили А класса
- Дополнительные и универсальные профиля
- Дополнительные профиля 58мм
- Дополнительные профиля 70мм
- Подствочные профиля
- Фурнитура для окон и дверей из пластикового профиля
- Фурнитура для ПВХ дверей
- Фурнитура СТН для ПВХ окон
- Армирование
- Уплотнители
- Комплектующие для москитной сетки
- Комплектующие для окон
- Комплектующие для производства стеклопакета
- Крепеж
- Оконная химия
- Подоконники
- Монтажная пена
- Дополнительная комплектация
- ПВХ профиль
- Где купить
- Окна Funke
- Окна Novotex
- Сертификаты
- Сертификаты Novotex
- Сертификаты Funke
- Сертификаты Витраж
- Сертификаты Уплотнение
- Сертификаты Сатурн (СТН)
- Контакты
Владивосток
+7(423) 262-03-97
Будни: с 9 до 18, СБ-ВС: выходной
- Следите за нами в соц.
 сетях:
сетях: - © 2019, «Алюмтрейд»
Политика конфиденциальности - Разработка сайта —
- ПВХ профиль
- Фурнитура для окон и дверей из пластикового профиля
- Дополнительная комплектация
- Уплотнители
- Подоконники
- Монтажная пена
- Армирование
- Владивосток: +7 (423) 262-03-97
- Хабаровск: +7 (4212) 46-56-02
- Южно-Сахалинск: +7 (4242) 798-115
- Благовещенск: +7 (4162) 77-15-30
- Разработка сайта —
Владивосток
Хабаровск
Благовещенск
Южно-Сахалинск
Профили из стеклопластика | Сырье для профилей из стеклопластика
Если профиль должен находиться в агрессивной среде, используется «поверхностная вуаль». Это может быть тонкий мат из стекловолокна, тонкий мат из термопластичного полиэстера или акриловый мат, который укладывается на всю поверхность профиля для защиты стекловолокна от коррозии и последующего ухудшения механических свойств профиля.
Это может быть тонкий мат из стекловолокна, тонкий мат из термопластичного полиэстера или акриловый мат, который укладывается на всю поверхность профиля для защиты стекловолокна от коррозии и последующего ухудшения механических свойств профиля.
Процесс пултрузии требует, чтобы определенное количество волокон было ориентировано в направлении пултрузии, но в противном случае армирование может быть структурировано бесчисленным множеством способов в зависимости от нагрузки.
2 Матрица
Роль матрицы в композитном профиле частично состоит в том, чтобы связать арматуру вместе, а частично в том, чтобы удерживать арматуру в правильном положении по отношению к поперечному сечению с целью оптимального использования механических свойств. Тип матрицы также определяет такие свойства, как коррозионная стойкость, электроизоляционные свойства, огнестойкость и термостойкость.
Следующие три типа матрицы в основном хорошо подходят для процесса пултрузии: полиэфирная, эпоксидная и фенольная.
Полиэстер
Полиэстер является наиболее часто используемой матрицей, так как он дает композит с хорошими универсальными свойствами.
Ненасыщенные полиэфиры можно разделить на три основные группы: ортополиэфиры, изополиэфиры и винилэфиры. По сравнению с ортополиэстером изополиэстер повышает ударопрочность, обеспечивает большую гибкость и повышает термостойкость. Это также повышает коррозионную стойкость.
Винилэстер имеет еще лучшую коррозионную стойкость и термические свойства. Поскольку виниловый эфир обладает более высокими свойствами удлинения, чем орто- и изополиэфир, он также обеспечивает композит с лучшей ударопрочностью и улучшенными усталостными свойствами.
Эпоксидная смола
Эпоксидная смола используется в основном для профилей, армированных углеродом, придавая композитам лучшие усталостные и механические свойства. Эпоксидная смола более устойчива к термическим воздействиям и обладает лучшими электрическими свойствами.
Фенол
Фенол применяют при требованиях к высокой огнестойкости, термостойкости, малому дымообразованию, замедлению воспламенения при воздействии огня.
Добавки
«Добавки» — это общий термин, используемый для агентов, которые добавляются в матрицу. В зависимости от назначения добавки можно разделить на три основные группы: добавки, снижающие цену, технологические добавки и функциональные добавки. Хотя назначение может быть разным, добавки всегда будут влиять на коррозионную стойкость профилей, а также на их механические и пожарно-технические свойства.
Технологические добавки
Технологические добавки — это вещества, оказывающие благотворное влияние на процесс пултрузии, а также на свойства и внешний вид отвержденного профиля. Одним из примеров является «низкопрофильная добавка», используемая для предотвращения чрезмерной усадки при отверждении профилей. Добавка предотвращает образование микротрещин на поверхностях, одновременно повышая коррозионную стойкость профиля и улучшая усталостные свойства. Это также дает профилям более точные геометрические допуски и более низкое внутреннее напряжение.
Это также дает профилям более точные геометрические допуски и более низкое внутреннее напряжение.
Функциональные добавки
Функциональные добавки оказывают благотворное влияние на использование готового профиля. Одним из примеров является добавление пигментов. Еще одним примером является добавление антипиренов. Последние добавляются для получения самозатухающих свойств и для замедления распространения пламени.
Разумеется, функциональные добавки также могут быть добавлены в таких больших количествах, что это ухудшит механические свойства профиля.
См. также Кодекс качества Fiberline на стр. 0.10-0.11 Руководства по проектированию Fiberline.
Добавки, снижающие цену*
Единственной функцией добавок, снижающих цену, является заполнение формы профиля, а добавление таких добавок позволяет сократить использование более дорогих армирующих и матричных материалов. Таким образом, можно соответственно снизить цену на готовые профили. Профили имеют значительно худшие механические свойства при уменьшении количества армирования. Кроме того, большинство типов добавок, снижающих цену, также приводят к получению профилей с более низкой коррозионной стойкостью и пониженной устойчивостью к большинству химических веществ.
Профили имеют значительно худшие механические свойства при уменьшении количества армирования. Кроме того, большинство типов добавок, снижающих цену, также приводят к получению профилей с более низкой коррозионной стойкостью и пониженной устойчивостью к большинству химических веществ.
*Часто называют «наполнителями».
Bristol Myers Squibb — Bristol Myers Squibb объявляет о пятилетних данных долгосрочного исследования DAYBREAK, подтверждающего профиль эффективности и безопасности Zeposia (озанимод) у пациентов с рецидивирующими формами рассеянного склероза
Лечение Zeposia продемонстрировало низкую годовую частоту рецидивов (ARR) 0,103, и более 70% пациентов не имели рецидивов в течение четырех лет
Безопасность соответствовала предыдущим выводам и установленному профилю безопасности Zeposia в течение 5 лет наблюдения
ПРИНСТОН, Нью-Джерси — (БИЗНЕС ПРОВОД) —
Компания Bristol Myers Squibb (NYSE: BMY) объявила сегодня о промежуточных результатах открытого расширенного исследования DAYBREAK 3, демонстрирующего долгосрочный профиль эффективности и безопасности препарата Zeposia (озанимод) у пациентов с рецидивирующими формами рассеянного склероза (РС). . Эти данные (презентация № P737) и пять дополнительных тезисов из исследований, спонсируемых компанией, будут представлены на 37 9 конференции.0083-й Конгресс Европейского комитета по лечению и исследованиям рассеянного склероза (ECTRIMS), который состоится виртуально 13-15 октября 2021 г.
. Эти данные (презентация № P737) и пять дополнительных тезисов из исследований, спонсируемых компанией, будут представлены на 37 9 конференции.0083-й Конгресс Европейского комитета по лечению и исследованиям рассеянного склероза (ECTRIMS), который состоится виртуально 13-15 октября 2021 г.
«Раннее и эффективное вмешательство может значительно повлиять на физические и когнитивные результаты с течением времени, а низкая частота рецидивов является важным показателем результатов лечения пациентов», — сказал Брюс Кри, доктор медицинских наук, магистр наук, исследователь и профессор клинической неврологии Университета штата Нью-Йорк. Калифорнийский институт неврологии Сан-Франциско (UCSF) Вайля и директор по клиническим исследованиям Центра MS UCSF. «Эти данные исследования DAYBREAK дают четкую картину долгосрочного профиля безопасности и эффективности Zeposia , и усилить его потенциал при использовании на ранних стадиях лечения людей, живущих с рецидивирующими формами рассеянного склероза».
В расширенном исследовании DAYBREAK безопасность соответствовала предыдущим выводам, и в течение отчетного периода не было выявлено новых сигналов безопасности при длительном применении Zeposia . Лечение препаратом Zeposia продемонстрировало низкую годовую частоту рецидивов (ARR) 0,103. Через 36 и 48 месяцев у 75% и 71% участников не было рецидивов, а подтвержденное прогрессирование инвалидности через 3 и 6 месяцев наблюдалось у 13,9 человек.% и 11,4% участников исследования соответственно.
«Наши презентации на ECTRIMS 2021 подкрепляют растущее количество доказательств, подчеркивающих долгосрочную эффективность и безопасность препарата Zeposia для лечения рецидивирующих форм рассеянного склероза, и демонстрируют нашу нацеленность на предоставление значимых инноваций, помогающих сохранить тело и разум людей, живущих с рассеянным склерозом. », — сказал Джонатан Садех, доктор медицины, магистр наук, глава отдела иммунологии и развития фиброза, Bristol Myers Squibb. «Мы стремимся расширять наши знания об этой непредсказуемой, изнурительной болезни с целью преобразования медицины с помощью науки».
«Мы стремимся расширять наши знания об этой непредсказуемой, изнурительной болезни с целью преобразования медицины с помощью науки».
В исследовании DAYBREAK из 2494 участников, получавших Zeposia в среднем в течение 46,8 месяцев, у 2143 участников (85,9%) были какие-либо нежелательные явления, связанные с лечением (TEAE), у 298 (11,9%) были серьезные TEAE и у 75 (3,0%). %) прекратили исследование из-за TEAE. Наиболее частыми TEAE были назофарингит (19,6%), головная боль (15,8%), инфекции верхних дыхательных путей (11,1%) и лимфопения (10,3%). Данные этого долгосрочного обсервационного исследования пациентов, получавших лечение до 62,7 месяцев, согласуются с установленным профилем безопасности Zeposia и с устойчивым контролем активности заболевания и прогрессирования инвалидности.
На Конгрессе ECTRIMS 2021 Бристоль Майерс Сквибб и его сотрудники представят несколько тезисов, которые подкрепляют растущий объем исследований компании в области рассеянного склероза и приверженность людей, живущих с этим заболеванием. Принятые тезисы доступны на сайте Конгресса ECTRIMS 2021.
Принятые тезисы доступны на сайте Конгресса ECTRIMS 2021.
Посетите эту страницу на BMS.com для получения дополнительной информации о научном подходе и ресурсах Bristol Myers Squibb по РС.
Резюме презентаций:
Исследования Bristol Myers Squibb, представленные на Конгрессе ECTRIMS 2021, включают:
- Долгосрочная безопасность и эффективность озанимода при рецидивирующем рассеянном склерозе: промежуточный анализ открытого расширенного исследования DAYBREAK
Автор: Krzysztof W. Selmaj
Номер презентации: P737
Тема презентации: Долгосрочный мониторинг лечения
- Безопасность озанимода для печени при рецидивирующем рассеянном склерозе в открытом расширенном исследовании DAYBREAK
Автор: Кшиштоф В. Зельмай
Номер презентации: P725
Тема презентации: Долгосрочный мониторинг лечения
- Программа фармаконадзора за озанимодом, недавно одобренным препаратом для лечения рецидивирующих форм рассеянного склероза.

Автор: Соня Афсари
Номер презентации: P156
Тема презентации: Эпидемиология
- Влияние озанимода на подтипы циркулирующих лейкоцитов у пациентов с рецидивирующим рассеянным склерозом и сравнение со здоровыми добровольцами
Автор: Сара Харрис
Номер презентации: P659
Тема презентации: Иммуномодуляция/иммуносупрессия
- Взаимосвязь между изменениями уровня глиального фибриллярного кислого белка во время лечения и клиническими исходами у пациентов с рецидивирующим рассеянным склерозом: постфактум анализ фазы 3 исследования озанимода SUNBEAM
Автор: Сара Харрис
Номер презентации: P570
Тема презентации: Жидкие биомаркеры
- Схемы лечения пациентов с рассеянным склерозом: когортное исследование одной больницы в Швеции
Автор: Анна Каштелу-Бранко
Номер презентации: P905
Тема презентации: Другое
О Рассвете
DAYBREAK — это многоцентровое долгосрочное открытое расширенное (OLE) рандомизированное двойное слепое исследование с активным контролем и параллельными группами фазы 3 для оценки безопасности и эффективности препарата Zeposia (озанимод ) вводят перорально пациентам с рецидивирующими формами рассеянного склероза (РС).
Подходящие пациенты из исследований RADIANCE, SUNBEAM и RPC01-1001 с диагнозом рецидивирующие формы рассеянного склероза зачисляются на лечение до окончания исследования DAYBREAK или до прекращения программы разработки. Пациенты в исследовании получают Zeposia 0,92 мг (эквивалентно 1 мг озанимода HCl). В общей сложности исходные клинические испытания завершили 2639 участников, и этот промежуточный анализ (дата отсечки — февраль 2021 г.) включает в общей сложности 2494 участника со средним (диапазоном) воздействием Zeposia в течение 46,8 (0,03–62,7) месяцев в OLE.
Основной целью исследования является оценка безопасности в общей популяции. Bristol Myers Squibb благодарит пациентов и исследователей, участвующих в этом клиническом испытании.
О рассеянном склерозе
Рассеянный склероз (РС) — инвалидизирующее, непредсказуемое заболевание, при котором иммунная система атакует защитную миелиновую оболочку, покрывающую нервы. Повреждение миелина нарушает связь между мозгом и остальным телом. В конечном итоге сами нервы могут ухудшиться — процесс, который в настоящее время является необратимым. Рассеянным склерозом страдают 700 000 человек в Европе и примерно 2,5 миллиона человек во всем мире.
Повреждение миелина нарушает связь между мозгом и остальным телом. В конечном итоге сами нервы могут ухудшиться — процесс, который в настоящее время является необратимым. Рассеянным склерозом страдают 700 000 человек в Европе и примерно 2,5 миллиона человек во всем мире.
Рецидивирующие формы рассеянного склероза, в том числе клинически изолированный синдром, рецидивирующе-ремиттирующее заболевание и активное вторично-прогрессирующее заболевание, характеризуются четко выраженными приступами ухудшения неврологической функции. За этими приступами, часто называемыми рецидивами, вспышками или обострениями, следуют периоды частичного или полного восстановления. В течение этих периодов выздоровления, также называемых ремиссиями, симптомы частично или полностью улучшаются без видимого прогрессирования заболевания. Поскольку рецидивы рассеянного склероза непредсказуемы, пациенты могут чувствовать разочарование, стресс или страх, когда они происходят. Рецидивирующие формы РС являются наиболее частым течением заболевания на момент постановки диагноза.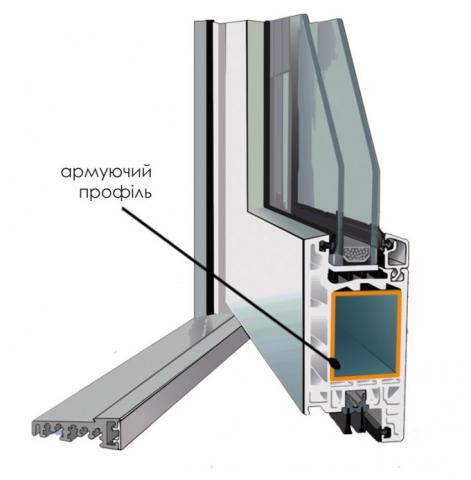 Приблизительно у 85% больных первоначально диагностируют рецидивирующие формы РС по сравнению с 10-15% при прогрессирующих формах заболевания.
Приблизительно у 85% больных первоначально диагностируют рецидивирующие формы РС по сравнению с 10-15% при прогрессирующих формах заболевания.
Bristol Myers Squibb: новаторские пути в области иммунологии для изменения жизни пациентов
Bristol Myers Squibb вдохновлен единым видением — изменить жизнь пациентов с помощью науки. Для людей, живущих с иммуноопосредованными заболеваниями, изнурительная реальность постоянных хронических симптомов и прогрессирования заболевания может сказаться на их физическом, эмоциональном и социальном благополучии, делая простые задачи и повседневную жизнь проблемой. Руководствуясь нашим глубоким пониманием иммунной системы, основанным на более чем 20-летнем опыте, и нашей страстью помогать пациентам, компания продолжает следовать новаторским наукам с целью предоставления значимых решений, отвечающих неудовлетворенным потребностям в ревматологии, гастроэнтерологии, дерматологии и многих других областях. склероз. Мы следуем научным данным, стремясь адаптировать методы лечения к индивидуальным потребностям, улучшать результаты и расширять возможности лечения, работая над выявлением механизмов, которые могут обеспечить долгосрочную ремиссию — и, возможно, даже излечение — в будущем.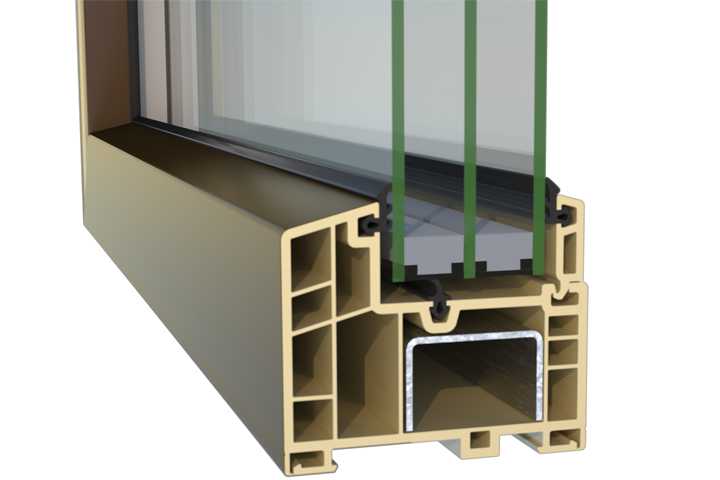 Выстраивая партнерские отношения с исследователями, пациентами и лицами, осуществляющими уход, для предоставления инновационных методов лечения, Bristol Myers Squibb стремится поднять уход за пациентами до новых стандартов и выполнить самое главное — обещание лучшей жизни.
Выстраивая партнерские отношения с исследователями, пациентами и лицами, осуществляющими уход, для предоставления инновационных методов лечения, Bristol Myers Squibb стремится поднять уход за пациентами до новых стандартов и выполнить самое главное — обещание лучшей жизни.
О Зепосия (озанимод)
Zeposia (озанимод) представляет собой пероральный модулятор рецептора сфингозин-1-фосфата (S1P), который с высоким сродством связывается с рецепторами S1P 1 и 5. Zeposia блокирует способность лимфоцитов выходить из лимфатических узлов, уменьшая количество лимфоцитов. в периферической крови. Механизм, с помощью которого Zeposia оказывает терапевтическое действие при рассеянном склерозе, неизвестен, но может включать снижение миграции лимфоцитов в центральную нервную систему.
Препарат Zeposia был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для лечения взрослых с рецидивирующими формами рассеянного склероза в марте 2020 года. болезнь, определяемая клиническими или визуальными признаками, в мае 2020 года. FDA одобрило Zeposia для лечения взрослых с активным язвенным колитом средней и тяжелой степени 27 мая 2021 года.
болезнь, определяемая клиническими или визуальными признаками, в мае 2020 года. FDA одобрило Zeposia для лечения взрослых с активным язвенным колитом средней и тяжелой степени 27 мая 2021 года.
УТВЕРЖДЕННЫЕ FDA США ПОКАЗАНИЯ ДЛЯ ZEPOSIA
ZEPOSIA (озанимод) показан для лечения:
1. Рецидивирующие формы рассеянного склероза (РС), включая клинически изолированный синдром, рецидивирующе-ремиттирующее заболевание и активное вторично-прогрессирующее заболевание у взрослых.
2. Активный язвенный колит (ЯК) средней и тяжелой степени у взрослых.
ВАЖНАЯ ИНФОРМАЦИЯ О БЕЗОПАСНОСТИ
Противопоказания:
- Пациенты, перенесшие в течение последних 6 мес инфаркт миокарда, нестабильную стенокардию, инсульт, транзиторную ишемическую атаку (ТИА), декомпенсированную сердечную недостаточность, требующую госпитализации, или сердечную недостаточность III/IV класса, или наличие болезни Мобитц II II или III степени степень атриовентрикулярной (АВ) блокады, синдрома слабости синусового узла или синоатриальной блокады, если у пациента нет функционирующего кардиостимулятора
- Пациенты с тяжелым нелеченным апноэ сна
- Пациенты, принимающие ингибитор моноаминоксидазы (МАО)
Инфекции: ZEPOSIA может повышать восприимчивость к инфекциям.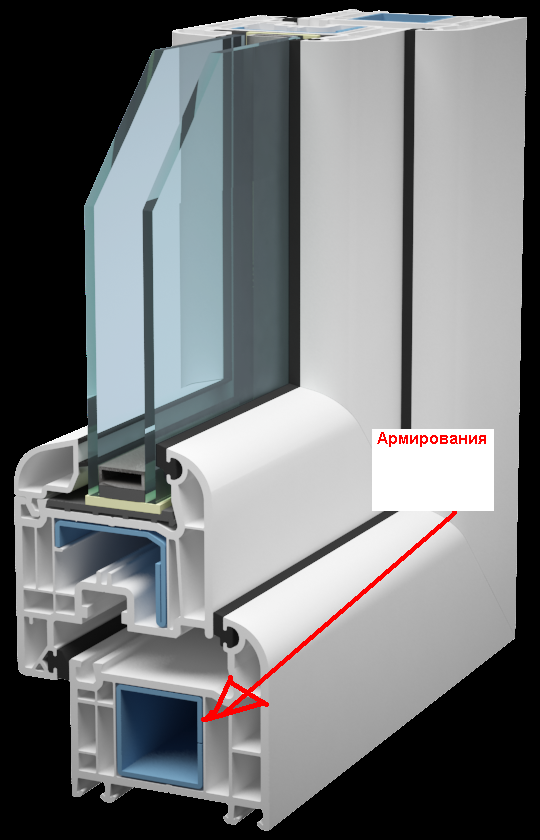 У пациентов, получавших ZEPOSIA, возникали опасные для жизни и редкие смертельные инфекции. Получите недавний (т. е. в течение 6 месяцев или после прекращения предшествующей терапии РС или ЯК) полный анализ крови (CBC), включая количество лимфоцитов, до начала ZEPOSIA. Отложите начало ZEPOSIA у пациентов с активной инфекцией до тех пор, пока инфекция не будет устранена. Рассмотрите возможность прерывания лечения препаратом ЗЕПОЗИЯ, если у пациента развивается серьезная инфекция. Продолжайте следить за инфекциями в течение 3 месяцев после прекращения приема ZEPOSIA.
У пациентов, получавших ZEPOSIA, возникали опасные для жизни и редкие смертельные инфекции. Получите недавний (т. е. в течение 6 месяцев или после прекращения предшествующей терапии РС или ЯК) полный анализ крови (CBC), включая количество лимфоцитов, до начала ZEPOSIA. Отложите начало ZEPOSIA у пациентов с активной инфекцией до тех пор, пока инфекция не будет устранена. Рассмотрите возможность прерывания лечения препаратом ЗЕПОЗИЯ, если у пациента развивается серьезная инфекция. Продолжайте следить за инфекциями в течение 3 месяцев после прекращения приема ZEPOSIA.
- Опоясывающий герпес был зарегистрирован как побочная реакция у пациентов, получавших ZEPOSIA. Сообщалось о случаях герпесного энцефалита и менингита ветряной оспы при применении модуляторов рецепторов сфингозин-1-фосфата (S1P). Пациенты без подтвержденного медицинским работником анамнеза ветряной оспы (ветряной оспы) или без документов о полном курсе вакцинации против вируса ветряной оспы (VZV) должны быть проверены на антитела к VZV до начала ZEPOSIA.
 Полный курс вакцинации против ветряной оспы пациентам с отрицательным антителом рекомендуется перед началом лечения препаратом ЗЕПОСИА.
Полный курс вакцинации против ветряной оспы пациентам с отрицательным антителом рекомендуется перед началом лечения препаратом ЗЕПОСИА. - Сообщалось о случаях фатального криптококкового менингита (КМ) у пациентов, получавших другой модулятор рецептора S1P. При подозрении на ВМ применение ЗЕПОЗИИ следует приостановить до тех пор, пока не будет исключена криптококковая инфекция. При диагностированном ВМ необходимо начать соответствующее лечение.
- Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) представляет собой оппортунистическую вирусную инфекцию головного мозга, которая обычно возникает у пациентов с ослабленным иммунитетом и обычно приводит к смерти или тяжелой инвалидности. Сообщалось о ПМЛ у пациентов, получавших модуляторы рецептора S1P и другие методы лечения РС и ЯК, и он был связан с некоторыми факторами риска. Если есть подозрение на ПМЛ, отмените ZEPOSIA и проведите соответствующую диагностическую оценку. В случае подтверждения лечение Зепозией следует прекратить.

- В клинических исследованиях РС и ЯК пациенты, получавшие ZEPOSIA, не должны были получать сопутствующее лечение противоопухолевыми, некортикостероидными иммунодепрессантами или иммуномодулирующими препаратами, используемыми для лечения РС и ЯК. Ожидается, что одновременное применение ZEPOSIA с любым из этих методов лечения увеличит риск иммуносупрессии. При переходе на ZEPOSIA с иммунодепрессантов учитывайте продолжительность их действия и способ их действия, чтобы избежать непреднамеренных аддитивных иммунодепрессивных эффектов.
- Следует избегать использования живых аттенуированных вакцин во время и в течение 3 месяцев после лечения препаратом ЗЕПОЗИЯ. Если требуется иммунизация живой аттенуированной вакциной, введите ее не менее чем за 1 месяц до начала вакцинации ZEPOSIA.
Брадиаритмия и задержки атриовентрикулярной проводимости: Поскольку начало приема ZEPOSIA может привести к преходящему снижению частоты сердечных сокращений и задержке атриовентрикулярной проводимости, рекомендуется титрование дозы, чтобы помочь уменьшить сердечные эффекты. Начало лечения ЗЕПОЗИЕЙ без увеличения дозы может привести к более выраженному снижению частоты сердечных сокращений. Если рассматривается лечение с помощью ZEPOSIA, следует обратиться за советом к кардиологу для следующих лиц:
Начало лечения ЗЕПОЗИЕЙ без увеличения дозы может привести к более выраженному снижению частоты сердечных сокращений. Если рассматривается лечение с помощью ZEPOSIA, следует обратиться за советом к кардиологу для следующих лиц:
- со значительным удлинением интервала QT
- с аритмиями, требующими лечения антиаритмическими препаратами класса 1а или III
- с ишемической болезнью сердца, сердечной недостаточностью, остановкой сердца или инфарктом миокарда в анамнезе, цереброваскулярными заболеваниями и неконтролируемой артериальной гипертензией
- с атриовентрикулярной блокадой типа Мобитц II второй степени или выше, синдромом слабости синусового узла или синоатриальной блокадой сердца в анамнезе
Повреждение печени: У пациентов, получающих ZEPOSIA, может наблюдаться повышение активности аминотрансфераз. Проведите тесты функции печени, если они не были доступны в последнее время (например, в течение 6 месяцев), до начала лечения Зепозией. Пациентам, у которых развиваются симптомы, указывающие на дисфункцию печени, следует проверить уровень печеночных ферментов, а при подтверждении значительного поражения печени прием Зепозии следует прекратить. Следует соблюдать осторожность при использовании ZEPOSIA у пациентов со значительным заболеванием печени в анамнезе.
Пациентам, у которых развиваются симптомы, указывающие на дисфункцию печени, следует проверить уровень печеночных ферментов, а при подтверждении значительного поражения печени прием Зепозии следует прекратить. Следует соблюдать осторожность при использовании ZEPOSIA у пациентов со значительным заболеванием печени в анамнезе.
Риск для плода: Адекватных и хорошо контролируемых исследований у беременных женщин не проводилось. Согласно исследованиям на животных, ZEPOSIA может нанести вред плоду. Женщины детородного возраста должны использовать эффективные средства контрацепции, чтобы избежать беременности во время лечения и в течение 3 месяцев после прекращения приема препарата Зепозия.
Повышение артериального давления: Повышение систолического давления наблюдалось примерно через 3 месяца лечения и сохранялось на протяжении всего лечения. Артериальное давление следует контролировать во время лечения и регулировать соответствующим образом. Некоторые продукты, которые могут содержать очень большое количество тирамина, могут вызывать тяжелую гипертензию у пациентов, принимающих ZEPOSIA. Пациентам следует рекомендовать избегать продуктов, содержащих очень большое количество тирамина, при приеме ZEPOSIA.
Некоторые продукты, которые могут содержать очень большое количество тирамина, могут вызывать тяжелую гипертензию у пациентов, принимающих ZEPOSIA. Пациентам следует рекомендовать избегать продуктов, содержащих очень большое количество тирамина, при приеме ZEPOSIA.
Респираторные эффекты: ZEPOSIA может вызывать снижение легочной функции. При наличии клинических показаний во время терапии следует проводить спирометрическую оценку функции дыхания.
Макулярный отек: модуляторы S1P связаны с повышенным риском макулярного отека. Пациенты с увеитом или сахарным диабетом в анамнезе относятся к группе повышенного риска. Пациенты с такими состояниями в анамнезе должны проходить офтальмологическую оценку глазного дна, включая макулу, до начала лечения и регулярных последующих обследований. Офтальмологическое обследование рекомендуется всем пациентам в любое время в случае изменения зрения. Дальнейшее использование ZEPOSIA у пациентов с макулярным отеком не оценивалось; потенциальные преимущества и риски для отдельного пациента следует учитывать при принятии решения о прекращении применения препарата Зепозия.
Синдром задней обратимой энцефалопатии (PRES): Сообщалось о редких случаях PRES у пациентов, получавших модулятор рецепторов S1P. Если у пациента, получающего препарат Зепозия, развиваются неожиданные неврологические или психические симптомы или любые симптомы/признаки, указывающие на повышение внутричерепного давления, следует провести полное физикальное и неврологическое обследование. Симптомы PRES обычно обратимы, но могут развиться в ишемический инсульт или кровоизлияние в мозг. Задержка в диагностике и лечении может привести к необратимым неврологическим последствиям. При подозрении на PRES лечение препаратом ZEPOSIA следует прекратить.
Непреднамеренные аддитивные иммунодепрессивные эффекты от предшествующих иммунодепрессантов или иммуномодулирующих препаратов: При переходе с препаратов с пролонгированными иммунодепрессивными эффектами необходимо учитывать период полувыведения и способ действия этих препаратов, чтобы избежать непреднамеренных аддитивных иммунодепрессивных эффектов и в то же время свести к минимуму риск реактивации заболевания. Не рекомендуется начинать лечение ZEPOSIA после лечения алемтузумабом.
Не рекомендуется начинать лечение ZEPOSIA после лечения алемтузумабом.
Серьезное увеличение инвалидности после остановки ZEPOSIA: Редко сообщалось о тяжелом обострении заболевания, включая рецидив заболевания, после прекращения приема модулятора рецептора S1P. Следует учитывать возможность тяжелого обострения заболевания после прекращения лечения ZEPOSIA, поэтому после прекращения лечения пациенты должны находиться под наблюдением.
Воздействие на иммунную систему после прекращения приема ZEPOSIA: После прекращения приема ZEPOSIA среднее время возвращения числа лимфоцитов к нормальному диапазону составило 30 дней, при этом примерно 90% пациентов в пределах нормы в течение 3 месяцев. Использование иммунодепрессантов в течение этого периода может привести к аддитивному эффекту на иммунную систему, поэтому следует соблюдать осторожность при назначении других препаратов через 4 недели после последней дозы ZEPOSIA.
Наиболее частые побочные реакции, возникшие в клинических исследованиях РС у пациентов, получавших ZEPOSIA (≥ 4%): инфекции верхних дыхательных путей, повышение уровня печеночных трансаминаз, ортостатическая гипотензия, инфекция мочевыводящих путей, боль в спине и гипертензия.
В клинических исследованиях язвенного колита наиболее частыми побочными реакциями, возникавшими у ≥4% пациентов, получавших ZEPOSIA, и чаще, чем у пациентов, получавших плацебо, были инфекции верхних дыхательных путей, повышение печеночных проб и головная боль.
Для получения дополнительной информации о безопасности см. полную информацию о назначении лекарств и руководство по лекарствам .
О компании Bristol Myers Squibb
Bristol Myers Squibb — глобальная биофармацевтическая компания, миссия которой — открывать, разрабатывать и поставлять инновационные лекарства, помогающие пациентам победить серьезные заболевания. Для получения дополнительной информации о Bristol Myers Squibb посетите наш сайт BMS.com или подпишитесь на нас в LinkedIn, Twitter, YouTube, Facebook и Instagram.
Celgene и Juno Therapeutics являются дочерними компаниями, находящимися в полной собственности Bristol-Myers Squibb Company. В некоторых странах за пределами США, в соответствии с местным законодательством, Celgene и Juno Therapeutics называются Celgene, компанией Bristol Myers Squibb, и Juno Therapeutics, компанией Bristol Myers Squibb.
Предостережение относительно прогнозных заявлений
Этот пресс-релиз содержит «прогнозные заявления» по смыслу Закона о реформе судебных разбирательств по частным ценным бумагам от 1995 в отношении, среди прочего, исследований, разработок и коммерциализации фармацевтических продуктов. Все заявления, которые не являются заявлениями об исторических фактах, являются или могут считаться прогнозными заявлениями. Такие прогнозные заявления основаны на исторических показателях и текущих ожиданиях и прогнозах относительно наших будущих финансовых результатов, целей, планов и задач и связаны с неотъемлемыми рисками, предположениями и неопределенностями, включая внутренние или внешние факторы, которые могут задержать, отклонить или изменить любой из них. в ближайшие несколько лет, которые трудно предсказать, могут быть вне нашего контроля и могут привести к тому, что наши будущие финансовые результаты, цели, планы и задачи будут существенно отличаться от тех, которые выражены или подразумеваются в заявлениях. Эти риски, допущения, неопределенности и другие факторы включают, среди прочего, соответствие результатов будущих постмаркетинговых исследований результатам, полученным на сегодняшний день, и будет ли Zeposia по таким показаниям, описанным в этом выпуске, коммерчески успешным, и продолжение одобрения таких продукт для таких показаний может зависеть от проверки и описания клинической пользы в дополнительных подтверждающих исследованиях. Никакие прогнозные заявления не могут быть гарантированы. Прогнозные заявления в этом пресс-релизе следует оценивать вместе со многими рисками и неопределенностями, влияющими на бизнес и рынок Bristol Myers Squibb, особенно с теми, которые указаны в предупредительном заявлении и обсуждении факторов риска в годовом отчете Bristol Myers Squibb по форме 10-K для год, закончившийся 31 декабря 2020 г., согласно нашим последующим квартальным отчетам по форме 10-Q, текущим отчетам по форме 8-K и другим документам, поданным в Комиссию по ценным бумагам и биржам.
Эти риски, допущения, неопределенности и другие факторы включают, среди прочего, соответствие результатов будущих постмаркетинговых исследований результатам, полученным на сегодняшний день, и будет ли Zeposia по таким показаниям, описанным в этом выпуске, коммерчески успешным, и продолжение одобрения таких продукт для таких показаний может зависеть от проверки и описания клинической пользы в дополнительных подтверждающих исследованиях. Никакие прогнозные заявления не могут быть гарантированы. Прогнозные заявления в этом пресс-релизе следует оценивать вместе со многими рисками и неопределенностями, влияющими на бизнес и рынок Bristol Myers Squibb, особенно с теми, которые указаны в предупредительном заявлении и обсуждении факторов риска в годовом отчете Bristol Myers Squibb по форме 10-K для год, закончившийся 31 декабря 2020 г., согласно нашим последующим квартальным отчетам по форме 10-Q, текущим отчетам по форме 8-K и другим документам, поданным в Комиссию по ценным бумагам и биржам.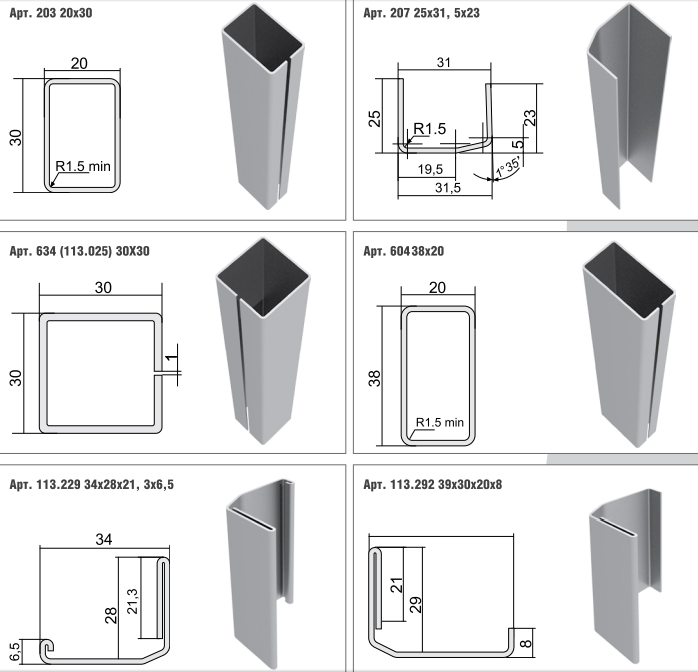
 сетях:
сетях:
 Полный курс вакцинации против ветряной оспы пациентам с отрицательным антителом рекомендуется перед началом лечения препаратом ЗЕПОСИА.
Полный курс вакцинации против ветряной оспы пациентам с отрицательным антителом рекомендуется перед началом лечения препаратом ЗЕПОСИА.